อะตอมและสมบัติของธาตุ
แบบจำลองอะตอมของดอลตัน
จากการที่ไม่มีผู้ใดเห็นลักษณะอะตอมด้วยตาเปล่า John Dalton นักวิทยาศาสตร์ชาวอังกฤษ ได้เสนอแนวคิดเกี่ยวกับอะตอมที่เรียกว่าทฤษฎีอะตอม ในปี ค.ศ. 1803(พ.ศ.2346) มีใจความสำคัญว่า
1. สสารทุกชนิดประกอบด้วยอนุภาคที่เล็กที่สุด ซึ่งไม่สามารถแบ่งแยกต่อไปได้อีก เรียกว่าatom
2. อะตอมของธาตุชนิดเดียวกัน ย่อมมีสมบัติเหมือนกันทุกประการ(เช่นมีมวลเท่ากัน) และมีสมบัติแตกต่างจากอะตอมของธาตุอื่น
3. ไม่สามารถทำให้อะตอมสูญหายหรือเกิดใหม่ได้ (กฎทรงมวล)
4. สารประกอบเกิดจากการรวมตัวทางเคมีระหว่างอะตอมของธาตุตั้งแต่สองชนิดขึ้นไป และจำนวนอะตอมของธาตุที่รวมตัวกันจะเป็นอัตราส่วนตัวเลขลงตัวน้อยๆ (กฎสัดส่วนคงที่)
Dalton เสนอมโนภาพของแบบจำลองอะตอมว่า อะตอมมีลักษณะทรงกลมตัน มีขนาดเล็กมาก และไม่สามารถแบ่งแยกได้อีก จากแนวคิดของดอลตันที่ว่า อะตอมเป็นหน่วยที่เล็กที่สุดซึ่งแบ่งแยกไม่ได้ ทำให้ได้แบบจำลองอะตอมของดอลตันเป็น “ทรงกลมที่มีขนาดเล็กที่สุด ซึ่งแบ่งแยกไม่ได้”
แบบจำลองอะตอมของดอลตันใช้อธิบายเกี่ยวกับกฏทรงมวลสารสัมพันธ์ได้ จึงเป็นที่ยอมรับกันในสมัยนั้น และทำให้นักวิทยาศาสตร์เริ่มหันมาสนใจศึกษาเกี่ยวกับอะตอมมากขึ้น ต่อมาเมื่อการศึกษาได้พัฒนามากขึ้น พบข้อมูลเกี่ยวกับอะตอมมากขึ้น ข้อมูลใหม่ ๆ เหล่านี้บางประการก็ไม่สอดคล้องกับแนวความคิดของดอลตัน เช่น พบว่าอะตอมไม่ใช่หน่วยที่เล็กที่สุด อะตอมยังสมารถมีอนุภาคย่อย ๆ ลงไปได้อีกก อะตอมของธาตุชนิดเดียวกันก็อาจไม่จำเป็นต้องมีสมบัติต่าง ๆ เหมือนกันทุกประการ เช่น มีมวลต่างกันได้ (คือไอโซโทป ซึ่งจะได้กล่าวในรายละเอียดต่อไป ) นอกจากนี้ข้อมูลบางเรื่องก็ไม่สามารถอธิบายได้โดยแนวความคิดของดอลตัน เช่น ปรากฏการณ์ที่เกิดขึ้นในหลอดรังสีแคโทด นักวิทยาศาสตร์คนต่อ ๆ มาจึงได้พยายามเสนอแบบจำลองอะตอมชนิดใหม่
เมื่อนักวิทยาศาสตร์ได้ทำการทดลองค้นคว้าได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น พบว่าแบบจำลองของ dalton ไม่สามารถอธิบายได้ เช่น
1. ทำไมอะตอมของธาตุต่างกันจึงมีมวลต่างกัน
2. อะตอมของธาตุชนิดเดียวกันอาจมีสมบัติต่างกันได้ (เช่น ไฮโดรเจนมี 3 ไอโซโทป1H,2H และ3H เป็นธาตุชนิดเดียวกัน แต่มีมวลต่างกัน)
3. ทำไมธาตุจึงมีความว่องไวในการเกิดปฏิกิริยาต่างกัน
4. ทำไมธาตุหนึ่งๆทำปฏิกิริยาได้เฉพาะบางธาตุ
5. อะตอมทำให้เกิดขึ้นใหม่หรือเปลี่ยนไปเป็นอะตอมของธาตุอื่นได้ หรือสามารถสังเคราะห์อะตอมของธาตุใหม่ได้โดยอาศัยปฏิกิริยานิวเคลียร์
ด้วยสาเหตุดังกล่าวจึงทำให้มีผู้ศึกษาค้นคว้าแบบจำลองอะตอมใหม่เพื่ออธิบายสิ่งที่เกิดขึ้น
การทดลองของทอมสันเกี่ยวกับหลอดรังสีแคโทด
แบบจำลองอะตอมของทอมสัน
เซอร์โจเซฟ จอห์น ทอมสัน (Sir Loseph John Thomson) ได้ทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทดและ นอกจากนี้ยังมีนักวิทยาศาสตร์อื่น ๆ ที่สนใจเกี่ยวกับเรื่องนี้ เช่น ยูจีน โกลด์สไตน์ (Eugene Goldstein) และวิลเฮล์ม วีน (Wilhelm Wein) ซึ่งได้ทำการทดลองเกี่ยวหลอดรังสีแคโทด
โดยทอมสัน ได้ ดัดแปลงลักษณะของหลอดรังสีแคโทดจากเดิมเล็กน้อย เช่นมีการเติมฉากเรืองแสงไว้ในหลอดรังสีด้วย ดังในรูป และทอมสันได้นำผลการทดลองในลักษณะต่าง ๆ มาสรุปเกี่ยวกับแบบจำลองอะตอม โดยทำเป็นขั้น ๆ ดังนี้
1.บรรจุก๊าซชนิดหนึ่งในหลอดรังสีแคโทดที่ภายในมีขั้วไฟฟ้าแอโนด และแคโทดต่ออยู่กับเครื่องกำเนิดไฟฟ้ากระแสตรง ศักย์สูงที่ขั้วแอโนดเจาะรูเล็ก ๆ ตรงกลาง และปลายด้านหนึ่งของหลอดรังสีมีฉากเรืองแสง ก. ทำด้วย ZnS วางไว้ นำหลอดรังสีนี้ต่อเข้ากับเครื่องสูบสูญญากาศ
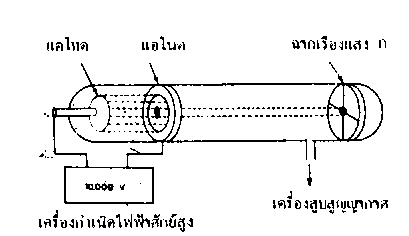
ในตอนแรกความดันในหลอดแก้วมีมาก จะยังไม่เห็นการเปลี่ยนแปลงใด ๆ ที่ฉากเรืองแสง แม้ว่าจะใช้ศักย์ไฟฟ้าสูง ๆเมื่อลดความดันในหลอดแก้วให้ต่ำลงมาก ๆ จนเกือบเป็นสุญญากาศ จะพบว่ามีจุดเรืองแสง หรือมีจุดสว่างบนฉากเรืองแสง ก.
เนื่องจาก ZnS มีสมบัติพิเศษคือ ถ้าอนุภาคมีประจุมากระทบจะทำให้เกิดการเรืองแสงขึ้น ดังนั้นจากผลการทดลองทำให้ ทอมสันตั้งสมมติฐานว่า
จะต้องมีรังสีชนิดหนึ่งซึ่งมีประจุไฟฟ้าพุ่งเป็นเส้นตรงจากขั้วแคโทดมายังฉากเรืองแสง ก. ซึ่งรังสีนี้อาจจะเกิดจากก๊าซที่มีอยู่ในหลอดแก้วนั้น หรืออาจจะเกิดจากโลหะที่ทำขั้วไฟฟ้าก็ได้ ซึ่งทอมสันยังไม่ทราบ
รวมทั้งยังไม่ทราบว่ารังสีที่พุ่งออกมานั้นมีประจุเป็นอย่างไร แต่ี้ทอมสันได้คาดว่าอะตอมคงจะไม่ใช่เป็นทรงกลมตันดังแบบจำลองของดอลตันแน่ แต่จะต้องมีอนุภาคเล็ก ๆ ที่มีประจุเป็นองค์ประกอบด้วย
การทดลองเพื่อทดสอบอนุภาคที่เกิดขึ้น
ในการทดสอบว่าประจุไฟฟ้าที่มากระทบฉากเรืองแสง ก. เป็นประจุบวกหรือลบ ทอมสันจึงได้ทดลองต่อไปโดยใช้สนามไฟฟ้าเข้าช่วย โดยยึดหลักที่ว่า อนุภาคที่มีประจุจะต้องเกิดการเบี่ยงเบนในสนามไฟฟ้าถ้าอนุภาคนั้นมีประจุบวกจะเบี่ยงเบนเข้าหาขั้วลบของสนามไฟฟ้าและถ้ามีประจุลบจะเบี่ยงเบนเข้าหาขั้วบวกทั้งนี้ศึกษาการเบี่ยงเบนได้จากฉากเรืองแสง
เมื่อเพิ่มขั้วไฟฟ้าเข้าไป 2 ขั้ว โดยให้ขั้วไฟฟ้าทั้งสอง มีสนามไฟฟ้าตั้งฉากกับทิศทางของรังสีดังในรูป
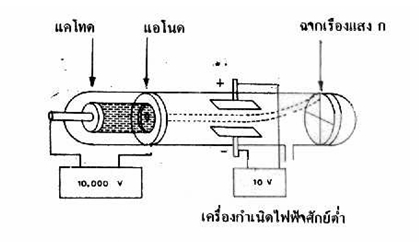
จากการทดลองพบว่า
- จุดสว่างบนฉากเรืองแสง ก. เบนไปจากตำแหน่งเดิม คือ เบี่ยงเบนขึ้นสู่ด้านบนซึ่งถ้าลากเส้นจากขั้วไฟฟ้าจะเห็นว่ารังสีนั้นเบี่ยงเบนเข้าหาขั้วบวกของสนามไฟฟ้า
แสดงว่ารังสีจะต้องประกอบด้วยอนุภาคที่มีประจุลบเนื่องจากรังสีนี้เคลื่อนที่ออกมาจากขั้วแคโทดซึ่งเป็นขั้วลบ จึงเรียกรังสีนี้ว่า รังสีแคโทดและเรียกหลอดแก้วที่ใช้ในการทดลองว่า หลอดรังสีแคโทด
ข้อสรุปที่ทอมสันได้
- ทอมสันได้ตั้งสมมติฐานขึ้นว่าอะตอมประกอบด้วยอนุภาคเล็กๆ ที่ส่วนหนึ่งมีประจุลบ
แต่มีประเด็นที่ต้องศึกษาเพิ่มอีก 2 ประเด็นคือ
ประเด็นที่ 1 อนุภาคที่มีประจุลบเหล่านี้ เกิดจากก๊าซในหลอดรังสี หรือเกิดจากขั้วไฟฟ้า
ประเด็นที่ 2 รังสีแคโทดนี้จะเหมือนกันหรือไม่จะประกอบด้วยอนุภาคชนิดเดียวกันหรือไม่ถ้าใช้ก๊าซต่างชนิดกันจะมีลักษณะเหมือนหรือต่างกันอย่างไร
ผลการศึกษาเพิ่มเติมของทอมสัน
ทอมสันศึกษาสมบัติของรังสีแคโทดโดยหาอัตราส่วนระหว่างประจุต่อมวลของรังสีนั้นทั้งนี้อาศัยหลักที่ว่านอกจากรังสีแคโทดจะเบี่ยงเบนได้ในสนามไฟฟ้าแล้ว ยังสามารถเบี่ยงเบนได้ในสนามแม่เหล็กด้วย
ในตอนแรกทอมสันได้ทดลอง
- เปลี่ยนก๊าซชนิดต่าง ๆ ในหลอดรังสีแคโทดแล้วทดลองในทำนองเดียวกัน ปรากฏผลการทดลองได้ผลเหมือนเดิม
-เปลี่ยนชนิดของขั้วไฟฟ้าที่ใช้ทำแคโทดก็ยังคงพบว่าได้ผลการทดลองเหมือนเดิม
(คือจะมีรังสีที่ประกอบด้วยอนุภาคที่มีประจุลบพุ่งมาที่ฉากเรืองแสง ก. และรังสีเกิดการเบี่ยงเบนเข้าหาขั้วบวกของสนามไฟฟ้า จึงทำให้ไม่สามารถจะพิสูจน์ว่าอนุภาคที่มีประจุลบนั้นเป็นอนุภาคชนิดเดียวกันหรือไม่)
(คือจะมีรังสีที่ประกอบด้วยอนุภาคที่มีประจุลบพุ่งมาที่ฉากเรืองแสง ก. และรังสีเกิดการเบี่ยงเบนเข้าหาขั้วบวกของสนามไฟฟ้า จึงทำให้ไม่สามารถจะพิสูจน์ว่าอนุภาคที่มีประจุลบนั้นเป็นอนุภาคชนิดเดียวกันหรือไม่)
ดังนั้นทอมสันจึงได้ทำการทดลองต่อโดยนำหลอดรังสีวางไว้ในสนามแม่เหล็ก ทั้งนี้ในทิศทางของสนามแม่เหล็กตั้งฉากกับสนามไฟฟ้าดังรูป ในช่วงแรกที่ใส่สนามแม่เหล็กเข้าไป จุดสว่างบนฉากเรืองแสง ก. จะเบี่ยงเบนขึ้นด้านบน เมื่อใส่สนามแม่เหล็กเข้าไป และเพิ่มอำนาจสนามแม่เหล็กทีละน้อยจะพบว่าจุดสว่างบนฉากเรืองแสง ก. ค่อย ๆ มีการเบี่ยงเบนน้อยลง คือ จุดเรืองแสงค่อย ๆ กลับมาสู่ตำแหน่งเดิมของตอนที่ไม่มีสนามไฟฟ้า แสดงว่าในขณะนี้ความแรงของสนามไฟฟ้ามีค่าเท่ากับความแรงของสนามแม่เหล็ก จุดสว่างบนฉากเรืองแสงจึงไม่มีการเบี่ยงเบน
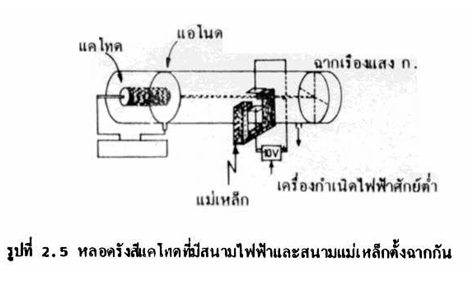
เมื่อนำความแรงเนื่องจากสนามไฟฟ้า และความแรงเนื่องจากสนามแม่เหล็กที่กระทำต่ออนุภาคลบมาคำนวณอัตราส่วนของประจุต่อมวล (e/m) ของอนุภาคลบนั้น ปรากฏว่าได้ค่าคงที่เท่ากันทุกครั้ง ไม่ว่าทอมสันจะใช้ก๊าซชนิดใด หรือไม่ว่าจะใช้โลหะใดเป็นแคโทดคือได้
e/m= 1.7 X 108 คูลอมบ์/กรัม
จากผลการทดลองและผลการคำนวณ ทำให้ทอมสันสรุปว่า
“อนุภาคลบในรังสีแคโทดจะต้องมีลักษณะเหมือนกัน และอะตอมทุกชนิดย่อมจะมีอนุภาคที่มีประจุลบเป็นองค์ประกอบเหมือนกัน และเรียกอนุภาคลบนี้ว่าอิเล็กตรอน”
เมื่อทดลองถึงตอนนี้ทำให้ทอมสันสรุปได้ว่า อะตอมไม่ใช่สิ่งที่เล็กที่สุด อะตอมของธาตุทุกชนิดจะต้องประกอบด้วยอิเล็กตรอนและอนุภาคอื่น ๆ ซึ่งในขณะนั้นยังไม่ทราบ
หลอดรังสีแคโทด
เป็นเครื่องที่ใช่ทดลองเกี่ยวกับการนำไฟฟ้าโดยหลอดรังสีแคโทดจะมีความดันต่ำมาก และความต่างศักย์สูงมาก วิลเลียม ครูกส์ได้สร้างหลอดรังสีแคโทดขึ้นมาโดยใช้แผ่นโลหะ 2 แผ่นเป็นขั้วไฟฟ้า โดยต่อขั้วไฟฟ้าลบกับขั้วลบของเครื่องกำเนิดไฟฟ้าเรียกว่า แคโทด และต่อขั้วไฟฟ้าบวกเข้ากับขั้วบวกของเครื่องกำเนิดไฟฟ้าเรียกว่า แอโนด
การค้นพบอิเล็กตรอนเซอร์โจเซฟ จอห์น ทอมสัน ดัดแปลงหลอดรังสีใหม่ ดังรูป
รังสีพุ่งจากด้าแคโทดไปยังด้านแอโนด และจะมีรังสีส่วนหนึ่งทะุลุออกไปกระทบกับฉากเรืองแสงหลังจากนั้นทอมสันได้เพิ่มขั้วไฟฟ้าเข้าไปในหลอดรังสีแคโทดดังรูป
ปรากฎว่า รังสีนี้จะเบี่ยงเบนเข้าหาขั้วบวก แสดงว่า รังสีนี้ต้องเป็นประจุลบแต่ไม่ทราบว่าเกิดจากก๊าซในหลอดรังสีแคโทดหรือเกิดจากขั้วไฟฟ้าทอมสันจึงทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทดพบว่าไม่ว่าจะใช้ก๊าซใดบรรจุในหลอดหรือใช้โลหะใดเป็นแคโทดจะได้ผลการทดลองเหมือนเดิมจึงสรุปได้ว่า อะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ เรียกว่า "อิเล็กตรอน"
การค้นพบโปรตอนเนื่องจากอะตอมเป็นกลางทางไฟฟ้า และการที่พบว่าอะตอมของธาตุทุกชนิดประกอบด้วยอิเล็กตรอนซึ่งมีประจุไฟฟ้าเป็นลบ ทำให้นักวิทยาศาสตร์เชื่อว่าองค์ประกอบอีกส่วนหนึ่งของอะตอม จะต้องมีประจุบวกด้วย ออยแกน โกลด์สไตน์ (Eugen Goldstein) นักวิทยาศาสตร์ชาวเยอรมัน ได้ทดลองเกี่ยวกับหลอดรังสีแคโทด โดยดัดแปลงหลอดรังสีแคโทด ดังรูป
ผลการทดลองของโกสไตน์
เมื่อผ่านกระแสไฟฟ้า ปรากฏว่ามีจุดสว่างเกิดขึ้นทั้งฉากเรืองแสง ก. และฉากเรืองแสง ข.
โกลสไตน์ได้อธิบายว่าจุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสงก.จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวกเคลื่อนที่ผ่านรูตรงกลางของแคโทด ไปยังฉากเรืองแสงแต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซหรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน ปรากฏว่า ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซ
ไม่ได้เกิดจากขั้วไฟฟ้า
ไม่ได้เกิดจากขั้วไฟฟ้า
สรุปแบบจำลองของทอมสัน
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
การค้นพบโปรตอน
เนื่องจากอะตอมเป็นกลางทางไฟฟ้า และการที่พบว่าอะตอมของธาตุทุกชนิดจะต้องประกอบด้วยอิเล็กตรอนซึ่งมีประจุลบ ทำให้นักวิทยาศาสตร์เชื่อว่า องค์ประกอบอีกส่วนหนึ่งของอะตอมจะต้องมีอนุภาคที่มีประจุบวกอยู่ด้วย
ออยเกน โกลด์สไตน์ (Eugen Goldstein) นักวิทยาศาสตร์ชาวเยอรมัน ได้ทำการทดลองเกี่ยวกับหลอดรังสีแคโทด โดยดัดแปลงหลอดรังสีแคโทดเล็กน้อย ดังในรูป
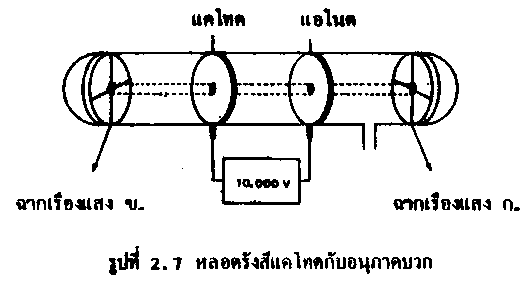 |
โกลด์สไตน์ได้เลื่อนขั้วแคโทดและแอโนดมาไว้เกือบตรงกลาง แล้วเพิ่มฉากเรืองแสง ข. ที่ปลายอีกด้านหนึ่งของหลอดแก้ว โดยคิดว่าการที่อนุภาคที่มีประจุลบสามารถเคลื่อนที่ผ่านขั้วแอโนดไปที่ฉากเรืองแสง ก. ได้ อนุภาคที่มีประจุบวกก็ควรจะเคลื่อนที่ผ่านแคโทดไปที่ฉากเรืองแสง ข. ได้เช่นเดียวกัน ดังนั้นจึงเจาะรูตรงกลางของขั้วแอโนดและแคโทดไว้ จากการทดลองเมื่อผ่านกระแสไฟฟ้า ปรากฏว่ามีจุดสว่างเกิดขึ้นทั้งบนฉากเรืองแสง ก. และ ข. ซึ่งโกลด์สไตน์อธิบายว่าจุดสว่างที่เกิดบนฉากเรืองแสง ข. จะต้องเกิดจากรังสีที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวกเคลื่อนที่ผ่านรูตรงกลางของแคโทดไปยังฉากเรืองแสง แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซหรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
จากการทดลองหลายครั้ง ๆ โดยการเปลี่ยนชนิดของก๊าซในหลอดแก้ว ปรากฏว่าอนุภาคที่มีประจุบวกเหล่านี้มีอัตราส่วนของประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของก๊าซที่ใช้ และเมื่อทดลองโดยเปลี่ยนโลหะที่ใช้ทำขั้วไฟฟ้าหลาย ๆ ชนิด แต่ใช้ก๊าซในหลอด แก้วชนิดเดียวกัน ปรากฏว่าผลการทดลองได้อัตราส่วนของประจุต่อมวลเท่ากัน แสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซ ไม่ได้เกิดจากขั้วไฟฟ้า
ต่อมาโกลด์สไตน์ได้พบว่าถ้าทำการทดลองโดยใช้ก๊าซไฮโดรเจน จะได้อนุภาคบวกที่มีจำนวนประจุเท่ากับประจุของอิเล็กตรอน และเรียกอนุภาคบวกที่เกิดจากก๊าซไฮโดรเจนว่า “โปรตอน” อะตอมของก๊าซไฮโดรเจนจะมี 1 โปรตอน และอะตอมของธาตุอื่น ๆ อนุภาคบวกจะมีมากกว่า 1 โปรตอน แต่จำนวนโปรตอนและอิเล็กตรอนเท่ากัน
จากผลการทดลองที่ผ่านมา ทั้งของทอมสัน และโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอมดังนี้
“อะตอมมีลักษณะเป็นทรงกลม ประกอบด้วยอนุภาคโปรตอนที่มีประจุบวกและอนุภาคอิเล็กตรอนซึ่งมีประจุลบกระจายอยู่ทั่วไปอย่างสม่ำเสมอในอะตอม อะตอมในสภาพที่เป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับประจุลบ”
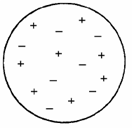
รูปที่ 1-8 แบบจำลองอะตอม ของ thomsom
ทอมสันได้นำแบบจำลองดังกล่าวมาอธิบายผลการทดลองดังนี้ เมื่ออะตอมของโลหะที่เป็นขั้วไฟฟ้าแคโทดได้รับพลังงานจากเครื่องกำเนิดไฟฟ้า จนกระทั่งพลังงานนั้นมีค่ามากพอที่จะทำให้เกิดการแตกตัว (Ionization) ให้อิเล็กตรอนออกมา
พลังงาน + M (s) --------------> M (g) ® M+(g) + e-
M คือ อะตอมของโลหะที่เป็นขั้วแคโทด
อิเล็กตรอนที่ออกมาจากแคโทดจะเคลื่อนที่ไปยังแอโนด ซึ่งในขณะที่เคลื่อนที่จะมีการชนอะตอมของก๊าซที่อยู่ภายในหลอดด้วย เนื่องจากอิเล็กตรอนที่ออกมาจากแคโทดมีพลังงานติดตัวออกมาด้วย เมื่อมีการชนกับอะตอมของก๊าซจะมีการถ่ายเทพลังงาน ซึ่งถ้ามีการชนที่แรงพอจนทำให้อะตอมของก๊าซที่ถูกชนเกิดการแตกตัวให้อิเล็กตรอนและอนุภาคที่มีประจุบวกออกมาเช่นเดียวกัน
อิเล็กตรอนจากขั้วไฟฟ้า A (g)-----------------------> A+(g) + e-
อิเล็กตรอนทั้งหมดจากขั้วไฟฟ้าและจากก๊าซซึ่งเรียกรวมกันว่ารังสีแคโทดจะพุ่งไปยังขั้วแอโนด บางส่วนจะวิ่งผ่านรูที่เจาะไว้ตรงกลางขั้วแอโนดไปกระทบฉากเรืองแสงทำให้เกิดจุดสว่างบนฉากเรืองแสงขึ้น เนื่องจากอะตอมของธาตุทุกชนิดประกอบด้วยอิเล็กตรอนอย่างเดียวกัน ดังนั้นไม่ว่าจะใช้โลหะใดเป็นขั้วไฟฟ้า หรือใช้ก๊าซใดใส่ในหลอดแก้ว จะได้รังสีแคโทดนิดเดียวกัน อัตราส่วนระหว่างประจุต่อมวลจึงเท่ากัน
ในขณะที่อิเล็กตรอนวิ่งไปยังแอโนด อนุภาคที่มีประจุบวก คือ A+จะวิ่งไปยังแคโทด และบางส่วนจะผ่านแคโทดตรงรูที่เจาะไว้ตรงกลางกระทบกับฉากเรืองแสง ทำให้เกิดจุดสว่างบนฉากเรืองแสงขึ้น แต่เนื่องจากอะตอมของก๊าซแต่ละชนิดมีมวลไม่เท่ากัน ดังนั้นอัตราส่วนของประจุต่อมวลของอนุภาคบวกจึงไม่เท่ากัน (สำหรับก๊าซต่างชนิดกัน)
เช่น He (g)-------------> He+(g) + e-
H (g) ---------> H+(g) + e-
ประจุต่อมวลของ He+(g) กับ H+(g) ย่อมไม่เท่ากัน เพราะมวลอะตอมของ He และ H ไม่เท่ากัน
การหาค่าประจุของอิเล็กตรอน
ใน พ.ศ. 2451 โรเบิร์ต แอนดรูส์ มิลลิแกน (Robert Andrews Millikan) นักวิทยาศาสตร์ชาวอเมริกาได้ทำการทดลองหาค่าประจุของอิเล็กตรอน โดยใช้การทดลองที่เรียกว่า “Oil drop experiment”
เครื่องมือประกอบด้วยขั้วไฟฟ้า 2 ขั้ว ต่ออยู่กับเครื่องกำเนิดไฟฟ้า ขั้วไฟฟ้าบนเป็นขั้วบวก และขั้วไฟฟ้าด้านล่างเป็นขั้วลบ ขั้วไฟฟ้าทั้ง 2 ใส่ไว้ในกล่องซึ่งมีอากาศอยู่ภายใน
เมื่อพ่นหยดน้ำมันเม็ดเล็ก ๆ เข้าไประหว่างขั้วไฟฟ้าทั้งสอง เนื่องจากน้ำมันแต่ละหยดมีมวล ดังนั้นจึงถูกแรงดึงดูดของโลกทำให้ตกลงมาสู่ด้านล่าง ในขณะที่เม็ดน้ำมันยังไม่มีประจุไฟฟ้า การที่จะบังคับให้เคลื่อนที่ขึ้นลงจึงยังทำไม่ได้ ดังนั้นในตอนแรกจึงต้องเติมประจุลงบนหยดน้ำมันก่อนโดยการฉายรังสีเอ็กซ์ ( X-Ray) เข้าไป รังสีเอ็กซ์จะไปชนกับอากาศภายในกล่อง ทำให้อะตอมของอากาศเกิดการแตกตัว
X-rays ® A (g)-----------> A+(g) + e-
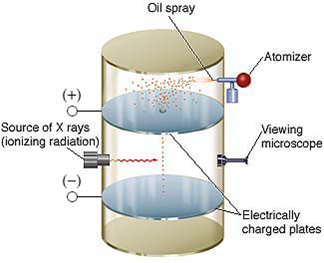
ในขณะที่ใส่สนามแม่เหล็กเข้าไป หยดน้ำมันที่มีอิเล็กตรอนเกาะอยู่จะมีประจุเป็นลบ และถูกดึงดูดให้ลอยขึ้นไปหาขั้วบวก ดังนั้นในตอนแรกหยดน้ำมันเหล่านี้จะเคลื่อนที่ลงได้ช้า และเมื่อเพิ่มศักย์ไฟฟ้าระหว่างขั้วให้มากขึ้น จนกระทั่งแรงดึงดูดเนื่องจากขั้วไฟฟ้ากับอิเล็กตรอนบนหยดน้ำมันเท่ากับแรงเนื่องจากแรงดึงดูดของโลก หยดน้ำมันเหล่านั้นจะลอยนิ่ง
จะเห็นได้ว่า ค่า m , g และ E สามารถหาได้ ดังนั้นจึงคำนวณประจุที่อยู่บนหยดน้ำมันได้ จากการทดลองพบว่าประจุที่อยู่บนหยดน้ำมันนั้นมีค่าเท่ากับ 1.60x 10-19คูลอมบ์ หรือเป็นจำนวนเท่าของ 1.60x10-19คูลอมบ์ เช่น 2x1.60x 10-19, 3 x1.60x10-19คูลอมบ์ เป็นต้น แสดงว่าจำนวนประจุที่อยู่บนหยดน้ำมันที่มีค่าน้อยที่สุดคือ 1.60x10-19คูลอมบ์ จำนวนประจุอื่น ๆ จะเป็นจำนวนเท่าของ 1.60x10-19ดังนั้นค่าของประจุ 1.60x10-19คูลอมบ์ จึงเป็นค่าประจุของอิเล็กตรอน 1 ตัว กล่าวคือ
ถ้ามีอิเล็กตรอน 1 ตัว เกาะบนหยดน้ำมัน จะได้ประจุ = 1.60x10-19คูลอมบ์
ถ้ามีอิเล็กตรอน 2 ตัว เกาะบนหยดน้ำมัน จะได้ประจุ = 2x1.60x10-19คูลอมบ์
ถ้ามีอิเล็กตรอน 3 ตัว เกาะบนหยดน้ำมัน จะได้ประจุ = 3x1.60x10-19คูลอมบ์
ดังนั้น จากการทดลองของมิลลิแกนได้ประจุของอิเล็กตรอนมีค่าเท่ากับ1.60x10-19คูลอมบ์
การคำนวณหามวลของอิเล็กตรอน
จากการทดลองของทอมสันได้ค้าประจุต่อมวลของอิเล็กตรอน คือ
= 1.7 X 108คูลอมบ์/กรัม
จากการทดลองของมิลลิแกน
ได้ค่าประจุของอิเล็กตรอน (e) = 1.60 x 10-19คูลอมบ์
เพราะฉะนั้นหามวลของอิเล็กตรอนได้ m = 9.41 x 10-28กรัม
แบบจำลองอะตอมของทอมสันนับว่าเป็นก้าวสำคัญเกี่ยวกับการศึกษาโครงสร้างของอะตอม ทำให้ได้มโนภาพของอะตอมที่ถูกต้องยิ่งขึ้น แต่อย่างไรก็ตามแบบจำลองอะตอมของทอมสันก็ยังไม่สามารถจะอธิบายผลการทดลองใหม่ ๆ อีกเป็นจำนวนมาก ซึ่งแสดงว่ายังไม่ใช่แบบจำลองที่สมบูรณ์ เป็นผลให้มีการค้นคว้าเพิ่มเติมขึ้น และมีการเสนอแบบจำลองใหม่ ๆ ขึ้นมา
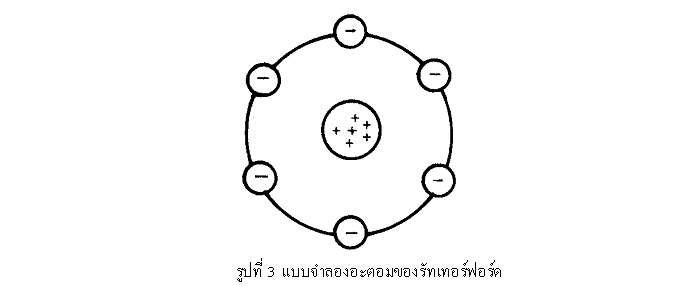
แบบจำลองอะตอมของรัทเทอร์ฟอรด์
หลังจากนักวิทยาศาสตร์ชาวฝรั่งเศส Henri Becquerel ได้พบสารกัมมันตรังสี และเรินต์เกน (W.K. Rontgen) ค้นพบ X-ray
Lord Ernest Ruthetford นักวิทยาศาสตร์ชาวนิวซีแลนด์ได้ทำการการศึกษาธรรมชาติของรังสีที่เกิดจากสารกัมมันตรังสี พบว่ามี 3 ชนิด คือ
1. รังสี เอลฟา ( α-ray) ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าเป็นบวก (+2) เป็นนิวเคลียสของอะตอมของธาตุฮีเลียม คือประกอบด้วย Proton 2 ตัว และ Neutron 2 ตัว ( ) อำนาจผ่านทะลุวัตถุได้น้อยมาก ถูกกั้นโดยกระดาษเพียงแผ่นเดียวหรือสองแผ่น He42
2. รังสีเบตา (β-ray) ประกอบด้วยอิเล็กตรอนที่มีพลังงานสูง มีอำนาจการผ่านทะลุสูงกว่ารังสีเเอลฟา ถูกกั้นโดยใช้แผ่นโลหะบางๆ
3. รังสีแกมมา (γ-ray) แสดงสมบัติเป็นคลื่นแม่เหล็กไฟฟ้าที่มีความยาวคลื่นสั้นมากคล้าย X-ray รังสีแกมมาไม่มีมวลไม่มีประจุ มีอำนาจผ่านทะลุสูง ถูกกั้นได้โดยแผ่นตะกั่วหนา
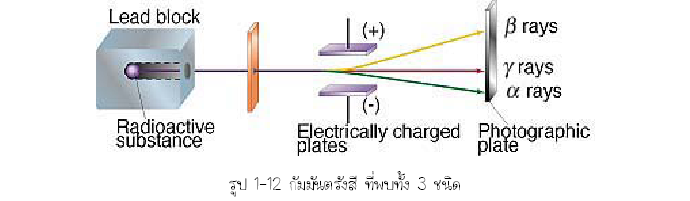
หลังจากที่ได้ศึกษาเกี่ยวกับสารกัมมันตรังสีมากขึ้น ได้มีการค้นพบรังสีต่าง ๆ ซึ่งเกิดจากการสลายตัวของสารกัมมันตรังสี เช่น รังสีแอลฟา (a ) เบตา (b) และแกรมมา (g) โดยเฉพาะรังสีแอลฟาซึ่งจัดว่าเป็นอนุภาคที่มีประจุไฟฟ้าบวก และมีมวลมากกว่ารังสีเบตา และแกรมมา เมื่ออนุภาคแอลฟาเคลื่อนที่ไปกระทบกับอนุภาคอื่น ๆ ที่มีมวลน้อยกว่า จึงไม่ค่อยมีการเบี่ยงเบนซึ่งทำให้นักวิทยาศาสตร์บางท่านนำเอารังสีแอลฟาไปศึกษาเกี่ยวกับโครงสร้างของอะตอม เช่น เออร์เนสต์ รัทเทอร์ฟอร์ด (Ernest Rutherford) นักวิทยาศาสตร์ชาวนิวซีแลนด์ เป็นต้น
ในปี พ.ศ. 2454 รัทเทอร์ฟอร์ด ได้ทำการทดลองในประเภทอังกฤษร่วมกับ ฮันส์ ไกเกอร์ และเออร์เนส์ มาร์สเดน ศึกษาทิศทางการเคลื่อนที่ของอนุภาคแอลฟา เมื่อยิงอนุภาคแอลฟาซึ่งได้จากการสลายตัวของสารกัมมันตรังสี เข้าไปที่แผ่นทองคำบาง ๆ
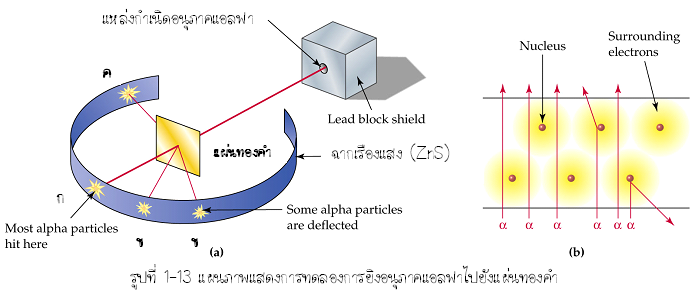
การตรวจสอบทิศทางการเคลื่อนที่ของอนุภาคแอลฟาหลังจากกระทบแผ่นทองคำแล้ว ทำได้โดยใช้ฉากเรืองแสงขดเป็นวงกลมล้อมรอบแผ่นทองคำไว้ โดยเว้นที่เฉพาะบริเวณที่จะให้อนุภาคแอลฟาผ่านเข้ามาเท่านั้น ทุก ๆ ครั้งที่อนุภาคแอลฟากระทบฉากเรืองแสงจะพบว่ามีจุดสว่างเกิดขึ้นที่ฉากเรืองแสงนั้น (อนุภาคแอลฟาคือ นิวเคลียสของธาตุฮีเลียม ซึ่งประจุบวก ดังนั้นเมื่อกระทบฉากเรืองแสงจึงมีจุดสว่างเกิดขึ้น ทำให้ทราบทิศทางการเคลื่อนที่ของอนุภาคแอลฟา) จากการทดลองพบว่าอนุภาคแอลฟาส่วนใหญ่จะวิ่งเป็นแนวเส้นตรง ผ่านแผ่นทองคำไปกระทบฉากเรืองแสง ซึ่งก็คือบริเวณจุด ก. ที่อยู่หลังแผ่นทองคำในรูป บางส่วนจะเบี่ยงเบนไปจากแนวเส้นตรง คือบริเวณจุด ข. ของฉากเรืองแสง และมีน้อยครั้งมากที่อนุภาคสะท้อนกลับมากระทบฉากเรืองแสงที่จุด ค. ซึ่งอยู่หน้าแผ่นทองคำ
จากผลการทดลอง ทำให้รัทเทอร์ฟอร์ดแปลกใจมาก เพราะถ้านำแบบจำลองอะตอมของทอมสันมาอธิบายทิศทางที่น่าจะเกิดขึ้น เมื่อยิงอนุภาคแอลฟาไปที่แผ่นทองคำ อนุภาคส่วนใหญ่ควรจะเบี่ยงเบนไปจากแนวเส้นตรง ทั้งนี้ เพราะตามแบบจำลองอะตอมของทอมสัน อะตอมประกอบด้วยอนุภาคบวกและลบ กระจายอยู่ทั่วไปในอะตอม เมื่อยิงอนุภาคแอลฟาซึ่งมีประจุบวกเข้าไปในอะตอมของแผ่นทองคำ อนุภาคแอลฟาควรจะผลักกับโปรตอนซึ่งมีประจุบวกเหมือนกัน อันจะเป็นผลทำให้ทิศทางของอนุภาคแอลฟาเบี่ยงเบนไปดังในรูปที่ 1-12 แต่จากผลการทดลอง การที่อนุภาคแอลฟาส่วนใหญ่วิ่งผ่านแผ่นทองคำเป็นแนวเส้นตรง จึงทำให้รัทเทอร์ฟอร์ดแปลกใจมาก โดยเฉพาะอนุภาคแอลฟาส่วนที่สะท้อนกลับยิ่งทำให้แปลกใจมากยิ่งขึ้น ทั้งนี้เพราะการที่อนุภาคแอลฟาสะท้อนกลับได้แสดงว่าภายในอะตอมจะต้องมีสิ่งที่มีมวลมากขวางทางอยู่ เมื่ออนุภาคแอลฟาไปชนจึงเกิดการสะท้อนกลับ แต่จากแบบจำลองอะตอมของทอมสันภายในอะตอมไม่มีสิ่งหนึ่งสิ่งใดอยู่รวมกันเป็นกลุ่มเป็นก้อนเลย ดังนั้นการสะท้อนกลับของอนุภาคแอลฟาเป็นมุมมากกว่า 90 องศา จึงไม่มีทางเกิดขึ้นได้
แต่จากผลการทดลองของ Rutherford ปรากฎว่าอนุภาคแอลฟาส่วนใหญ่วิ่งผ่านแผ่นทองคำเป็นเส้นตรง และมีส่วนที่เบี่ยงเบนออก และบางส่วนสะท้อนกลับ แสดงว่าแบบจำลองของ Thomson ไม่สอดคล้องกับผลการทดลอง Rutherford อธิบายผลการทดลองดังนี้
1. การที่อนุภาคแอลฟาส่วนใหญ่วิ่งผ่านแผ่นทองคำเป็นเส้นตรงแสดงว่าอะตอมไม่ใช่ของแข็งทึบตันแต่ภายในอะตอมมีที่ว่างอยู่มาก (ผลการทดลอง จุด ก เป็นจุดที่รังสีแอลฟาผ่านช่องว่างในอะตอมไปยังฉากมาก จุดนี้เรืองแสงมาก แสดงว่าอะตอมมีช่องว่างมาก)
2. อนุภาคแอลฟาบางอนุภาคที่หักเหออกจากทางเดิมเพราะภายในอะตอมมีอนุภาคที่มีมวลมากและมีประจุเป็นบวกสูง มีขนาดเล็ก ดังนั้นเมื่ออนุภาคแอลฟาเข้าใกล้อนุภาคนี้จะถูกผลักให้เบนออกจากทางเดิม หรือเมื่อนุภาคแอลฟากระทบโดยตรงก็เกิดการสะท้อนกลับ (เกิดการเรืองแสงที่จุด ข และ ค
การที่อนุภาคแอลฟาส่วนใหญ่เคลื่อนที่ผ่านอะตอมของทองคำเป็นแนวเส้นตรง แสดงว่าภายในอะตอมทองคำควรจะมีที่ว่างเป็นจำนวนมาก และการที่อนุภาคแอลฟาบางส่วนสะท้อนกลับแสดงว่าภายในอะตอมควรจะมีอนุภาคอะไรสักอย่างที่รวมกันเป็นกลุ่มก้อน และมีปริมาณมากพอ รวมทั้งมีมวลมากพอที่จะทำให้อนุภาคสะท้อนกลับเมื่อกระทบถูกได้ เนื่องจากภายในอะตอม (ในขณะนั้น) มีแต่อิเล็กตรอนและโปรตอน โดยที่อิเล็กตรอนมีมวลน้อยมาก รัทเทอร์ฟอร์ดจึงคิดว่าอนุภาคส่วนที่มารวมกันเป็นกลุ่มก้อนจึงน่าจะเป็นอนุภาคของโปรตอน ดังนั้นเพื่อที่จะอธิบายผลการทดลอง รัทเทอร์ฟอร์ดจึงเสนอแบบจำลองแบบใหม่ เรียกว่าแบบจำลองอะตอมของรัทเทอร์ฟอร์ดดังนี้
“อะตอมมีลักษณะเป็นทรงกลม ประกอบด้วยนิวเคลียสซึ่งก็คือโปรตอนที่รวมกันอยู่ตรงกลางของอะตอม และมีอิเล็กตรอนวิ่งวนอยู่รอบ ๆ นิวเคลียส นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุบวก ส่วนอิเล็กตรอนจะมีมวลน้อยและมีประจุลบ จำนวนอิเล็กตรอนจะเท่ากับจำนวนโปรตอน”
วิวัฒนาการของการสร้างตารางธาตุ
ความหมายของตารางธาตุ
ตารางธาตุ (Periodic Table ) คือตารางที่รวบรวมธาตุต่าง ๆ เข้าเป็นหมวดหมู่ ตามคุณสมบัติที่เหมือน ๆ กัน ไว้เป็นพวกเดียวกัน เพื่อสะดวกในการจดจำและศึกษา
สมบัติของธาตุ
ธาตุ(Element)คือ สารบริสุทธิ์ที่ประกอบด้วยอะตอมเพียงชนิดเดียว เช่น โซเดียม (Na) แมกนีเซียม (Mg) คาร์บอน (C) ออกซิเจน (O) เป็นต้น
ในการจัดธาตุออกเป็นหมวดหมู่จะอาศัยสมบัติที่คล้ายคลึงกันของธาตุแต่ละชนิดเป็นเกณฑ์ เช่น ใช้ความเป็นโลหะและอโลหะเป็นเกณฑ์ แบ่งได้เป็น 3 กลุ่ม คือ โลหะ กึ่งโลหะ และอโลหะ และยังสามารถแบ่งธาตุทั้ง 3 กลุ่มออกเป็นกลุ่มย่อยๆได้อีก เช่น แบ่งกลุ่มย่อยโดยใช้สถานะเป็นเกณฑ์ความว่องไวในการเกิดปฏิกิริยา และลักษณะที่อุณหภูมิปกติ เป็นต้น ดังแผนภาพเราแบ่งธาตุออกเป็น3ชนิดคือ
1. โลหะ(Metal)
2.อโลหะ(Non-metal)
3.กึ่งโลหะ ( Metalloid หรือ Semi metal )
สมบัติของโลหะ
- มีสถานะเป็นของแข็งที่อุณหภูมิปกติ (ยกเว้นปรอท เป็นของเหลว)
- มีจุดเดือดและจุดหลอมเหลวสูง
- แข็งและเหนียวสามารถตีเป็นแผ่นบางๆ หรือดึงให้เป็นเส้นได้
- นำไฟฟ้าและนำความร้อนได้ดี การนำไฟฟ้าลดลงเมื่ออุณหภูมิสูงขึ้น
- มีความแตกต่างของอุณหภูมิระหว่างจุดเดือดและจุดหลอมเหลวกว้าง
- เคาะมีเสียงดังกังวาน
- ขัดเป็นมันวาว
- มีความหนาแน่นสูง แต่บางชนิดมีความหนาแน่นต่ำ ได้แก่ โลหะเบา เช่นธาตุหมู่ I A และ II A
- มีค่า EN ต่ำ จึงเสียอิเล็กตรอนได้ง่ายเกิดเป็นไอออนบวก
- ทำปฏิกิริยากับกรดเกิดก๊าช ไฮโดรเจน ยกเว้นโลหะมีตระกูล
สมบัติของอโลหะ
- มีทั้ง 3 สถานะ คือ
- - ของแข็งเช่น คาร์บอน ( C ) กำมะถัน (S )
-ของเหลว เช่น โบรมีน
- ก๊าช เช่น ไฮโดรเจน ออกซิเจน
- มีจุดเดือดและจุดหลอมเหลวต่ำ ยกเว้นแกรไฟต์
- เปราะ แตกง่าย ตีเป็นแผ่นหรือดึงเป็นเส้นไม่ได้
- ไม่นำไฟฟ้าและความร้อน ยกเว้นแกรไฟต์
- มีความแตกต่างของอุณหภูมิระหว่างจุดเดือด และจุดหลอมเหลวแคบ
- เคาะไม่มีเสียงกังวาน
- ผิวไม่มันวาว
- มีความหนาแน่นต่ำ
- มีค่า EN สูง จึงรับอิเล็กตรอนได้ง่ายเกิดเป็นไอออนลบ
การจัดธาตุเป็นหมวดหมู่ของนักเคมียุคต่าง ๆ
ตารางธาตุ หมายถึง ตารางที่นักวิทยาศาสตร์สร้างขึ้นมา เพื่อแบ่งธาตุที่มีสมบัติเหมือนกันออกเป็นหมวดหมู่ เพื่อให้ง่ายแก่การศึกษา โดยแบ่งธาตุทั้งหมดออกเป็นหมู่และคาบ
ธาตุที่อยู่ในแนวดิ่งเดียวกัน เรียกว่า อยู่ในหมู่เดียวกัน
ธาตุที่อยู่ในแนวนอนเดียวกัน เรียกว่า อยู่ในคาบเดียวกัน
ในระหว่างปี พ.ศ. 2346 ถึง 2456 มีธาตุต่าง ๆที่พบในธรรมชาติประมาณ 63 ธาตุ ซึ่งนักวิทยาศาสตร์ได้พยายามจัดธาตุเหล่านี้ให้เป็นหมวดหมู่หรือเป็นตารางธาตุโดยในช่วงแรก ๆ นั้นแบ่งธาตุออกเป็นหมวดหมู่โดยอาศัยสมบัติของธาตุ ทั้งนี้ได้จากการสังเกตพบความคล้ายคลึงกันของสมบัติของธาตุเป็นกลุ่ม ๆ ทำให้นำมาจัดเป็นตารางธาตุได้ เช่นแบ่งกลุ่มโดยอาศัยสมบัติเกี่ยวกับโลหะ-อโลหะ โดยอาศัยสมบัติของความเป็นกรด-เบสของธาตุ เป็นต้น ต่อมาเมื่อหามวลอะตอมของธาตุได้ จึงใช้มวลอะตอมมาประกอบในการจัดตารางธาตุ จนในปัจจุบันจัดตารางธาตุโดยอาศัยการจัดเรียงอิเล็กตรอน
1. ตารางธาตุของเดอเบอไรเนอร์
การจัดตารางธาตุนั้นเริ่มขึ้นตั้งแต่ปี พ.ศ. 2360 (ค.ศ. 1817) โดย โยฮันน์ เดอเบอไรเนอร์ (Johaun Dobereiner) นักเคมีชาวเยอรมัน ได้นำธาตุต่าง ๆ ที่พบในขณะนั้นมาจัดเรียงเป็นตารางธาตุ โดยนำธาตุต่าง ๆ ที่มีสมบัติคล้ายคลึงกันมาจัดไว้ในหมู่เดียวกัน หมู่ละ 3 ธาตุ เรียงตามมวลอะตอมจากน้อยไปมากในแต่ละหมู่ มวลอะตอมของธาตุที่อยู่กลางจะเป็นค่าเฉลี่ยของมวลอะตอมของธาตุที่เหลืออีก 2 อะตอม เรียกว่ากฎชุดสาม(law of triads หรือ Dobereine’s law of triads)
ตารางที่ 8 มวลอะตอมเฉลี่ยของธาตุบางกลุ่มตามกฎชุดสาม
ธาตุ
|
มวลอะตอม
|
มวลอะตอมของธาตุแถวที่1 และ 3
|
Li
Na
K
Cl
Br
I
|
6.940
22.997
39.096
35.453
79.909
126.197
|
23.018
81.197
|
จะเห็นได้ว่ามวลอะตอมเฉลี่ย มีค่าใกล้เคียงกับมวลอะตอมของธาตุกลาง อย่างไรก็ตาม เมื่อนำกฎดังกล่าวไปใช้กับธาตุกลุ่มอื่นที่มีสมบัติคล้ายคลึงกัน ปรากฏว่าไม่มีผลเท่าที่ควร มวลอะตอมของธาตุกลางไม่เท่ากับค่าเฉลี่ยของมวลอะตอมของธาตุที่เหลือ กฎชุดสามของเดอเบอไรเนอร์จึงไม่เป็นที่ยอมรับกันในเวลาต่อมา
2. ตารางธาตุของนิวแลนด์
ในปี พ.ศ. 2407 (ค.ศ. 1864) จอห์น นิวแลนด์ (John Newlands) นักเคมีชาวอังกฤษได้พบว่าเมื่อนำธาตุต่าง ๆ มาเรียงลำดับตามมวลอะตอมจากน้อยไปหามาก ให้เป็นแถวตามแนวนอน สมบัติของธาตุจะมีลักษณะคล้ายกันเป็นช่วง ๆ ซึ่งลักษณะดังกล่าวเกิดขึ้นทุก ๆ ของธาตุที่ 8
เช่น ถ้าเริ่มต้นจากธาตุ Li แล้วเรียงลำดับมวลอะตอมไปถึงธาตุที่ 8 จะตรงกับ Na ซึ่ง Li และ Na มีสมบัติต่าง ๆ คล้ายคลึงกัน
ตารางที่9 ตัวอย่างการจัดตารางธาตุของนิวแลนด์ส์
H
|
Li
|
Be
|
B
|
C
|
N
|
O
|
F
|
Na
|
Mg
|
Al
|
Si
|
P
|
S
|
Cl
|
K
|
Ca
|
Cr
|
Ti
|
Mn
|
Fe
|
เรียกกฎการจัดตารางธาตุของนิวแลนด์ส์ว่า law of octaves หรือ Newlands’ law of octaves อย่างไรก็ตาม กฎนี้ไม่เป็นที่ยอมรับกัน เนื่องจากไม่สามารถอธิบายว่าเหตุใดมวลอะตอมจึงมาเกี่ยวข้องกับความคล้ายคลึงดังกล่าว นอกจากกฎนี้แล้วก็ยังใช้ได้กับ ธาตุที่มีมวลอะตอมต่ำ ๆ ไม่เกิน 20 ธาตุแรกเท่านั้น หลังจากนั้นจะใช้กฎนี้ไม่ได้
3. ตารางธาตุของเมนเดเลเอฟ
ในระหว่างปี พ.ศ. 2412 - 2413 (ค.ศ. 1269 - 1270) ยูลิอุส ไมเออร์ (Julius Meyer) นักวิทยาศาสตร์ชาวเยอรมัน และดิมิทรี เมนเดเลเอฟ (Dimitri Mendelejev) นักวิทยาศาสตร์ชาวรัสเซียได้พบในเวลาใกล้เคียงกันว่าสมบัติต่าง ๆ ของธาตุมีส่วนสัมพันธ์กับมวลอะตอมของธาตุกล่าวคือ “ถ้าเรียงลำดับธาตุตามมวลอะตอมจากน้อยไปหามาก จะพบว่าธาตุ ๆ ต่าง จะมีสมบัติคล้ายคลึงกันเป็นช่วง ๆ ” ซึ่งเมเดเลเอฟได้ตั้งเป็นกฎเรียกว่า “กฎพิริออดิก” หรือกฎตารางธาตุ (Periodic law) และพิมพ์เผยแพร่ในปี พ.ศ. 2412 ก่อนที่ไมเออร์จะพิมพ์เผยแพร่ครั้งหนึ่ง ดังนั้นเพื่อเป็นเกียรติแก่เมนเดเลเอฟ จึงเรียกตารางนี้ว่า “ตารางพีริออดิกของเมนเดเลเอฟ” หรือตารางธาตุของเมนเดเลเอฟ (Mendelejev’ s periodic table)
เกณฑ์ที่สำคัญที่เมนเดเลเอฟใช้คือ จัดธาตุที่มีสมบัติคล้ายคลึงกันที่ปรากฏซ้ำกันเป็นช่วง ๆ ให้อยู่ในหมู่หรือในแนวตั้งเดียวกัน และพยายามเรียงลำดับมวลอะตอมจากน้อยไปหามาก ในกรณีที่เรียงตามมวลอะตอมแล้วสมบัติของธาตุไม่สอดคล้องกัน ก็พยายามจัดให้เข้าหมู่โดยปล่อยให้ช่องว่างเว้นไว้ในตารางซึ่งเมนเดเลเอฟคิดว่า ช่องว่างเหล่านั้นน่าจะเป็นตำแหน่งของธาตุซึ่งยังไม่มีการค้นพบในขณะนั้น ในการจัดตารางธาตุนอกจากจะใช้มวลอะตอมแล้ว ยังใช้สมบัติทางเคมีและทางกายภาพของสารประกอบอื่น ๆ นอกเหนือจากสารประกอบคลอไรด์ และออกไซด์มาประกอบการพิจารณาด้วย
ตารางที่10 ตารางพิริออดิกของเมนเดเลเอฟ
หมู่ 1
|
หมู่ 2
|
หมู่ 3
|
หมู่ 4
|
หมู่ 5
|
หมู่ 6
|
หมู่ 7
|
หมู่ 8
| |
1
|
H 1
| |||||||
2
|
Li 7
|
Be 9.4
|
B 11
|
C 12
|
N 14
|
O 16
|
F 19
| |
3
|
Na 23
|
Mg 24
|
Al 27.3
|
Si 28
|
P 31
|
S 32
|
Cl 35.5
| |
4
|
K 29
|
Ca 40
|
-44
|
Ti 48
|
V 51
|
Cr 52
|
Mn 55
|
Fe 56 Co 59
Ni 59 Cu 63
|
5
|
(Cu 63 )
|
Zn 65
|
-68
|
-72
|
As 75
|
Se 78
|
Br 80
| |
6
|
Rb 85
|
Sr 87
|
? Yt 88
|
Zr 90
|
Nb 94
|
Mo 96
|
-100
|
Ru104 Rh104
Pd105 Ag 108
|
7
|
(Ag 108)
|
Cd 112
|
In 113
|
Sn 118
|
Sb 122
|
Te 125
|
1127
| |
8
|
Cs 133
|
Ba 137
|
? Di 138
|
? Ce 140
|
-
|
-
|
-
|
-
|
9
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
10
|
-
|
-
|
? Er 178
|
? La 180
|
Ta 182
|
W 184
|
-
|
Os 195 Ir197
|
11
|
(Au 199)
|
Hg 200
|
Tl 204
|
Bi 208
|
Bi 208
|
-
|
-
|
Pt 198 Au 199
|
12
|
-
|
-
|
-
|
-
|
-
|
U 240
|
-
|
- -
- -
|
ช่องว่างที่เว้นไว้คือตำแหน่งของธาตุที่ยังไม่พบในสมัยนั้น เนื่องจากตำแหน่งของธาตุในตารางธาตุสัมพันธ์กับสมบัติของธาตุ ทำให้เมนเดเลเอฟสามารถทำนายสมบัติของธาตุไว้ล่วงหน้าได้ด้วย โดยการศึกษาสมบัติเกี่ยวกับจุดหลอมเหลว จุดเดือด ความถ่วงจำเพาะ และความร้อนจำเพาะ รวมทั้งสมบัติเกี่ยวกับสารประกอบคลอไรด์ และออกไซด์
ตัวอย่างเช่น ธาตุที่อยู่ในช่องว่างใต้ Si เมนเดเลเอฟเรียกชื่อว่าธาตุเอคาซิลิคอน อีก 15 ปีต่อมาคือในปี พ.ศ. 2429 (ค.ศ. 1886) เคลเมนส์ วิงค์เลอร์ (Clemens Winkler) นักวิทยาศาสตร์ชาวเยอรมันจึงได้พบธาตุนี้และเรียกชื่อว่า ธาตุเจอร์เมเนียม (Ge) นั่นเอง
ตารางที่11 เปรียบเทียบสมบัติของธาตุเอคาซิลิคอนกับเจอร์เมเนียมที่ทำนายและที่ค้นพบ
สมบัติ
|
เอคาซิลิคอนทำนายเมื่อ พ.ศ. 2414 (ค.ศ. 1871)
|
เจอร์เมเนียมพบเมื่อ
พ.ศ. 2429 (ค.ศ.1886)
|
มวลอะตอม
สีของธาตุ
ความหนาแน่น (g/cm3)
จุดหลอมเหลว (0C )
สูตรของออกไซด์
ความหนาแน่นของออกไซด์ (g/cm3)
เมื่อผสมกับกรดไฮโดรคลอริก
|
72
เป็นโลหะสีเทา
5.5
สูง
GeO2
4.7
ละลายได้เล็กน้อย
|
72.6
เป็นโลหะสีเทา
5.36
958
GeO2
4.70
ไม่ละลายที่ 250C
|
นอกจากธาตุเอคาซิลิคอนแล้ว ยังมีธาตุอื่นที่เมนเดเลเอฟ ได้เรียกชื่อไว้ล่วงหน้า เช่น
ธาตุที่อยู่ใต้ B เรียกว่า เอคาโบรอน
ธาตุที่อยู่ใต้ Al เรียกว่า เอคาอะลูมิเนียม
ซึ่งปัจจุบันก็คือธาตุ Se และ Ga ตามลำดับ
การจัดตารางธาตุของเมนเดเลเอฟนั้น ถ้ายึดหลักการเรียงตามมวลอะตอมจากน้อยไปหามากอย่างเคร่งครัด จะทำให้ธาตุบางธาตุซึ่งมีสมบัติแตกต่างกันอยู่ในหมู่เดียวกัน ทำให้ต้องยกเว้นไม่เรียงตามมวลอะตอมบ้างแต่เมนเดเลเอฟก็ไม่สามารถให้เหตุผลได้ว่าเป็นเพราะเหตุใดจึงต้องเรียงลำดับธาตุเช่นนั้น เนื่องจากในขณะนั้นยังไม่มีความเข้าใจเกี่ยวกับโครงสร้างของอะตอมไม่มากพอ นักวิทยาศาสตร์ต่อ ๆ มาจึงสร้างแนวคิดใหม่ว่า ตำแหน่งของธาตุในตารางธาตุไม่ควรขึ้นอยู่กับมวลอะตอม แต่ควรจะขึ้นอยู่กับสมบัติอื่น ๆ ที่สัมพันธ์กับมวลอะตอม
4. ตารางธาตุของเฮนรี โมสลีย์
เฮนรี โมสลีย์ (Henry Moseley) นักวิทยาศาสตร์ชาวอังกฤษ ได้แก้ไขตารางธาตุของเมนเดเลเอฟให้ถูกต้องขึ้น โดยการพบว่าเลขอะตอม หรือจำนวนโปรตอนในนิวเคลียสของธาตุ มีความสัมพันธ์กับสมบัติของธาตุมากกว่ามวลอะตอม ทำให้สอดคล้องกับกฎพีริออดิกมากกว่า สามารถสร้างตารางธาตุได้โดยไม่ต้องสลับที่ธาตุบางธาตุเหมือนกรณีการจัดเรียงตามมวลอะตอม
ประมาณปี พ.ศ. 2456 (ค.ศ. 1913) โมสลีย์จึงเสนอตารางธาตุใหม่โดยเรียงตามเลขอะตอมจากน้อยไปหามาก และจัดธาตุที่มีสมบัติคล้ายคลึงกันให้อยู่ในหมู่เดียวกัน และกำหนดกฎตารางธาตุขึ้นใหม่เป็น “สมบัติต่าง ๆ ของธาตุในตารางธาตุขึ้นอยู่กับเลขอะตอมของธาตุ”
ตารางธาตุในปัจจุบัน
เนื่องจากปัจจุบันนักเคมีพบว่า การจัดเรียงตัวของอิเล็กตรอนในอะตอมของธาตุมีส่วนสัมพันธ์กับสมบัติต่าง ๆ ของธาตุ กล่าวคือ ถ้าเรียงลำดับธาตุตามเลขอะตอมจากน้อยไปหามาก จะพบว่าธาตุที่มีสมบัติคล้ายคลึงกันเป็นช่วง ๆ ตามลักษณะของการจัดเรียงอิเล็กตรอนในอะตอมของธาตุนั้น ดังนั้นในปัจจุบันจึงจัดตารางธาตุโดยเรียงตามเลขอะตอมจากน้อยไปมาก ดังในรูปที่ 1.23
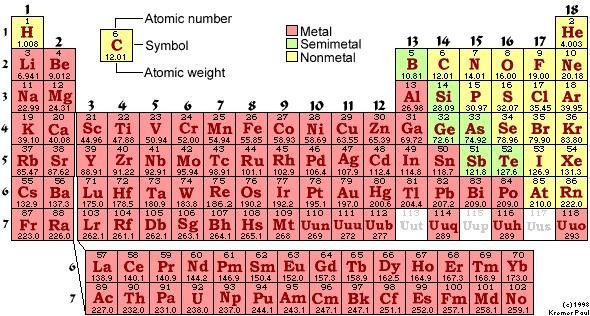
รูปที่1.23 ตารางธาตุในปัจจุบัน(ที่มา: www.specialedprep.net/.../compounds1.htm)
ตารางธาตุในรูปที่ 1.23 เป็นแบบที่ใช้กันอยู่มากในปัจจุบัน แบ่งธาตุในแนวตั้งออกเป็น 18 แถวหรือ 18 หมู่ โดยธาตุทั้งหมด 18 แถว แบ่งเป็น 2 กลุ่มใหญ่ ๆ คือกลุ่ม A และ B กลุ่ม A มี 8 หมู่ คือหมู่ IA ถึง VIIIA ส่วนกลุ่ม B ซึ่งอยู่ระหว่างหมู่ IIA และ IIIA มี 8 หมู่เช่นเดียวกัน คือ หมู่ IB ถึง VIIIB (แต่มี 10 แนวตั้ง) เรียกธาตุกลุ่ม B ว่าธาตุทรานซิชัน(Transition Elements)
ธาตุในแต่ละหมู่ ของกลุ่ม A ถ้ามีสมบัติคล้ายกันจะมีชื่อเรียกเฉพาะหมู่ เช่น
* ธาตุหมู่ IA เรียกว่าโลหะอัลคาไล(alkali metal) ได้แก่ Li , Na , K , Rb , Cs , Fr
* ธาตุหมู่ IIA เรียกว่าโลหะอัลคาไลน์เอิร์ท(alkaline earth)ได้แก่ Be Mg Ca Sr Ba Ra
* ธาตุหมู่ VIIA เรียกว่าธาตุเฮโลเจน(halogen) ได้แก่ F Cl Br I At
* ธาตุหมู่ที่ VIIIA เรียกว่าก๊าซเฉื่อย(Inert gas) ได้แก่ He Ne Ar Kr Xe Rn
สำหรับการแบ่งธาตุเป็นคาบ ธาตุทั้งหมดในตารางธาตุแบ่งเป็น 7 คาบ ซึ่งในแต่ละคาบอาจจะมีจำนวนธาตุไม่เท่ากัน เช่น
สำหรับคาบต่าง ๆ ในตารางธาตุแบ่งเป็น 7 คาบดังนี้
* คาบที่ 1 มี 2 ธาตุ คือ H , He
* คาบที่ 2 มี 8 ธาตุ คือ ตั้งแต่ Li ถึง Ne
* คาบที่ 3 มี 8 ธาตุ คือ ตั้งแต่ Na ถึง Ar
* คาบที่ 4 มี 18 ธาตุ คือ ตั้งแต่ K ถึง Kr
* คาบที่ 5 มี 18 ธาตุ คือ ตั้งแต่ Rb ถึง Xe
* คาบที่ 6 มี 32 ธาตุ คือ ตั้งแต่ Cs ถึง Rn
* คาบที่ 7 มี 19 ธาตุ คือ ตั้งแต่ Fr ถึง Ha
รวมทั้งหมด 105 ธาตุ เป็นก๊าซ 11 ธาตุ คือ H , N , O , F , Cl , He , Ne , Ar ,
Kr , Xe และ Rn เป็นของเหลว 5 ธาตุ คือ Cs , Fr , Hg , Ga และ Br ที่เหลือเป็นของแข็ง
สำหรับ 2 แถวล่างเลขอะตอม 57 - 70 และ 89 - 102 เป็นธาตุกลุ่มย่อยที่แยกมาจากหมู่ IIIB ในคาบที่ 6 และ 7 เรียกธาตุในกลุ่มย่อยนี้รวม ๆ ว่ากลุ่มธาตุเลนทาไนด์และกลุ่มธาตุแอกทิไนด์
นอกจากนี้เมื่อพิจารณาธาตุหมู่ IIIA ไปทางขวามือ จะพบเส้นหนักหรือเส้นทึบเป็นแบบขั้นบันได เส้นหนักนี้จะเป็นเส้นแบ่งกลุ่มธาตุโลหะและอโลหะ กล่าวคือ ธาตุทางขวาของเส้นขั้นบันไดจะเป็นอโลหะ ธาตุทางซ้ายมือของเส้นขั้นบันไดจะเป็นโลหะ ธาตุที่อยู่ชิดกับเส้นขั้นบันได เป็นธาตุกึ่งโลหะ ซึ่งมีทั้งสมบัติของโลหะและอโลหะ เช่น ธาตุ B , Si ,Ge ,As , Sb , Te
การตั้งชื่อธาตุที่ค้นพบใหม่
จากตารางธาตุในรูปที่ 1.23 จะพบว่ามีธาตุอยู่ 118 ธาตุ ซึ่งยังมีการค้นพบธาตุใหม่ ๆ เพิ่มขึ้นอีกหลายธาตุ แต่ยังไม่ได้กำหนดสัญลักษณ์ที่แน่นอนไว้ในตารางธาตุ ธาตุบางธาตุถูกค้นพบโดยนักวิทยาศาสตร์หลายคณะ ทำให้มีชื่อเรียกและสัญลักษณ์ต่างกัน
เช่น ธาตุที่ 104 ค้นพบโดยคณะนักวิทยาศาสตร์ 2 คณะ คือ คณะของนักวิทยาศาสตร์สหรัฐอเมริกา ซึ่งเรียกชื่อว่า รัทเทอร์ฟอร์เดียม (Ratherfordium) และใช้สัญลักษณ์ Rf ในขณะที่คณะนักวิทยาศาสตร์สหภาพโซเวียตเรียกชื่อว่าเคอร์ซาโตเวียม(Kurchatovium) ใช้สัญลักษณ์ Ku
ธาตุที่ 105 ค้นพบโดยคณะนักวิทยาศาสตร์ 2 คณะเช่นเดียวกัน คือคณะนักวิทยาศาสตร์สหรัฐอเมริกาเรียกชื่อว่า ฮาห์เนียม (Hahnium) และใช้สัญลักษณ์ Ha ในขณะที่นักวิทยาศาสตร์สหภาพโซเวียตใช้ชื่อว่า นิลส์บอห์เรียม (Neilbohrium) และใช้สัญลักษณ์เป็น Ns
การที่คณะนักวิทยาศาสตร์ต่างคณะตั้งชื่อแตกต่างกัน ทำให้เกิดความสับสน International Union of Pure and Applied Chemistry (IUPAC) จึงได้กำหนดระบบการตั้งชื่อขึ้นใหม่ โดยใช้กับชื่อธาตุที่มีเลขอะตอมเกิน 100 ขึ้นไป ทั้งนี้ให้ตั้งชื่อธาตุโดยระบุเลขอะตอมเป็นภาษาละติน แล้วลงท้ายด้วย iumระบบการนับเลขในภาษาละตินเป็นดังนี้
0 = nil (นิล) 1 = un (อุน)
2 = bi (ไบ) 3 = tri (ไตร)
4 = quad (ควอด) 5 = pent (เพนท์)
6 = hex (เฮกซ์) 7 = sept (เซปท์)
8 = oct (ออกตฺ) 9 = enn (เอนน์)
เช่น - ธาตุที่ 104 ตามระบบ IUPAC อ่านว่า อุนนิลควอเดียม (Unnilquadium) สัญลักษณ์Unq
- ธาตุที่ 105 ตามระบบ IUPAC อ่านว่า อุนนิลเพนเทียม (Unnilpentium) สัญลักษณ์Unp
การจัดตารางธาตุเป็นหมู่เป็นคาบ ทำให้ศึกษาสมบัติต่าง ๆ ของธาตุได้ง่ายขึ้น สามารถทำนายสมบัติบางประการของธาตุบางธาตุได้ กล่าวคือธาตุที่อยู่ในหมู่เดียวกันจะมีสมบัติต่าง ๆ คล้าย ๆ กัน และธาตุที่อยู่ในคาบเดียวกัน จะมีแนวโน้มของการเปลี่ยนแปลงสมบัติต่าง ๆ ต่อเนื่องกันไป ซึ่งจะกล่าวถึงรายละเอียดต่อไป


ไม่มีความคิดเห็น:
แสดงความคิดเห็น